
微信扫一扫
关注公众号
Science封面最新文章揭示新冠病毒人体蛋白受体结构
发布时间:2020-04-03 11:03 | 点击次数:3421
3 月 27 日,西湖大学研究团队的一篇学术论文,登上了著名学术期刊《Science》的封面,标题为“Structural basis for the recognition of the SARS-CoV-2 by full-length human ACE2”。这篇论文是《Science》刊载的第一篇专门研究新冠病毒的封面文章。该文章成功解析新型冠状病毒(SARS-CoV-2)细胞表面受体 ACE2 的全长三维结构,以及新冠病毒表面S蛋白受体结合结构域(RBD)与ACE2 全长蛋白复合物的三维结构。

>>>>>什么是 S 蛋白?
S 蛋白全称为 Spike Glycoprotein (刺突糖蛋白)。它位于新冠病毒最外层,像一个个突起的 “皇冠”。S蛋白可识别宿主细胞受体并介导膜融合,对于病毒颗粒进入细胞至关重要,是病毒感染宿主细胞的关键因子。根据美国得克萨斯大学奥斯汀分校研究团队的最新解析结果,新冠病毒 S 蛋白以三聚体形态存在,每一个单体中约有 1300 多个氨基酸,其中 300 多个氨基酸构成了RBD。RBD直接参与宿主受体的识别,该区域的氨基酸变异会导致病毒的种属嗜性和感染特性的变化。
新冠病毒S蛋白三聚体结构中,每一个S蛋白单体与相邻的S蛋白相互缠绕形成紧凑的同型三聚体,其中S1 trimer的SD1/SD2 domain与相邻S的S2亚基相互作用,这种相互缠绕的模式使得S1形成类似冠状的结构从而将S2 trimer锁定在prefusion的状态,而S1 RBD与受体ACE2的结合以及S1/S2边界处的酶切断裂,都会使S1三聚体冠状结构移除,从而造成S2大规模的构象变化,进而导致病毒膜与宿主膜融合。
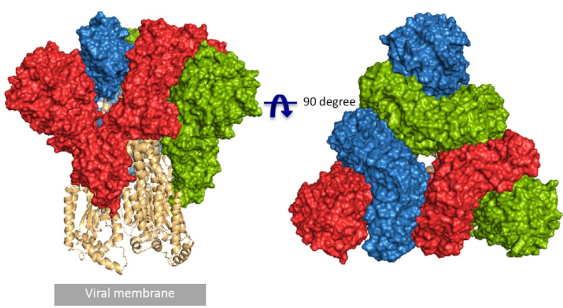
>>>>>S蛋白与ACE2复合物结构解析
对 S 蛋白和 ACE2 的研究,对于解释新冠病毒侵入细胞过程非常关键。获取新冠病毒的S蛋白与ACE2蛋白的复合物结构,将有助于理解新冠病毒对比SARS病毒与ACE2结合的差异,以及新冠病毒的S蛋白与ACE2 结合时的存在状态,因此,新冠病毒的S蛋白与ACE2蛋白的复合物结构为进一步精确地疫苗设计以及抗病毒药物的发现提供了重要的结构生物学基础。
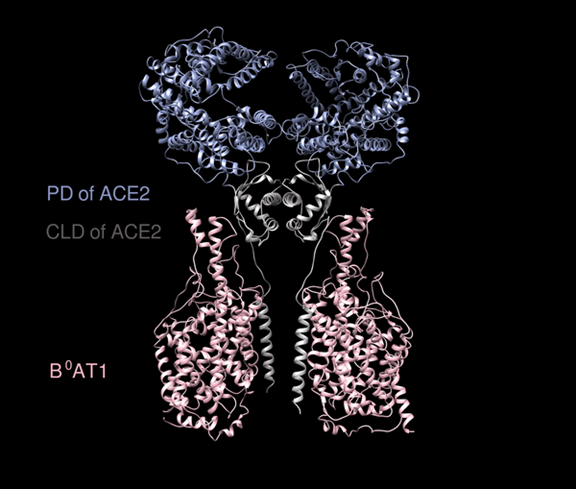
ACE2和B0AT1复合物的电镜图。PD(肽酶结构域,peptidasedomains)和CLD(Collectrin样域,Collectrin-like domain)。
此前,美国德克萨斯大学奥斯汀分校Jason S. McLellan研究组在Science杂志正式发表文章,他们利用冷冻电镜技术分析了2019-nCoV表面S蛋白的近原子结构。于此同时,西湖大学周强实验室利用冷冻电镜技术成功解析此次新冠病毒的受体ACE2的全长结构,这是世界上首次解析出ACE2的全长结构。
他们又进一步解析出了 ACE2 全长蛋白与新冠病毒 S 蛋白受体结合结构域的复合物结构,整体分辨率 2.9 埃(埃,1 埃等于 0.1 纳米),其中 S 蛋白受体结合结构域部分的分辨率为 3.5 埃。对于病毒识别至关重要的胞外结构域分辨率为2.7埃。3埃以内的电子密度图可以很清楚的确定侧链构象,侧链之间的盐键,氢键等相互作用。
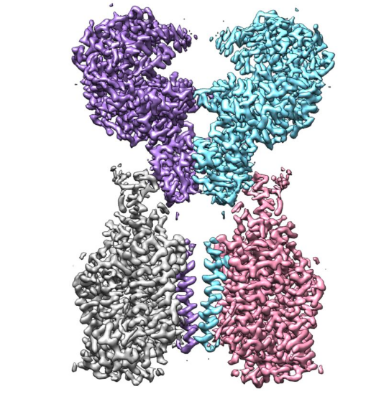
ACE2-B0AT1复合物的冷冻电镜密度图。
在形态上,新冠病毒的 S 蛋白像一座桥横跨在 ACE2 表面,又像病毒的一只手,紧紧抓住 ACE2,这一点与 SARS 病毒很相似。新冠病毒 S 蛋白的受体结合结构域与 SARS 病毒的序列也非常像,相似性达到 82%。
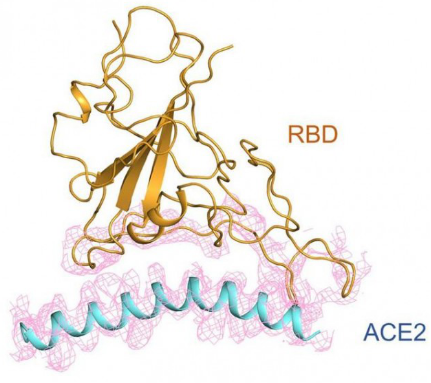
RBD与ACE2的相互作用示意图。
进一步分析,研究人员可以看到新冠病毒表面的 S 蛋白到底是由哪些氨基酸与ACE2 相互作用。可以看到,对比此前已经解析出来的 SARS 病毒与 ACE2 的相互作用,新冠病毒 S 蛋白有一部分氨基酸残基发生了较大改变。这也许可以解释为什么新冠病毒和 SARS 与 ACE2 的结合能力不一样,这种结合能力可能影响了病毒的传染力。
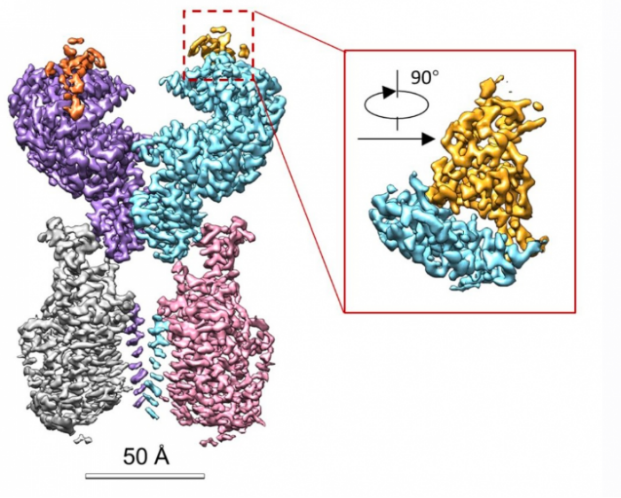
RBD-ACE2-B0AT1复合物的冷冻电镜密度图,框内为RBD与ACE2的相互作用界面。
而在这次研究的基础之上,计算生物学的研究人员可以在此基础上去构建不同的模型,进而展开具有针对性的研究,判断什么样的突变可能会进一步提高 S 蛋白与 ACE2 的相互作用,从而设计针对 S 蛋白或者 ACE2 蛋白的药物和抗体;又或者设计小分子破坏它们之间的相互作用。这些,都可以为药物设计和检测手段开发提供坚实的基础。
为了支持新冠病毒的研究和治疗诊断产品的开发,北京安必奇生物快速研发生产出新型冠状病毒相关蛋白和抗体产品,覆盖新冠病毒S蛋白、N蛋白和受体ACE2蛋白,满足科学研究、检测及中和抗体制备的需求。同时,我们提供其他冠状病毒(SARS、MERS等)相关蛋白产品。
产品列表
| Cat# | Product name | Identity | Source |
| Spike-19V | Recombinant COVID-19 Spike protein S1 subunit RBD, Mouse IgG1 Fc-tagged |
S1(RBD)-mFc | HEK293 |
| Spike-190V | Recombinant COVID-19 Spike protein RBD, His-tagged |
S1(RBD)-His | HEK293 |
| Spike-191V | Recombinant COVID-19 Spike protein S1 subunit, His-tagged |
S1-His | HEK293 |
| Spike-192V | 2019-nCoV Recombinant COVID-19 Spike protein S1 subunit, Human IgG1 Fc-tagged |
S1-hFc | HEK293 |
| Spike-194V | Recombinant COVID-19 Spike protein (S1+S2 ECD), His-tagged |
S1+S2(ECD)-His | Baculovirus-Insect Cells |
| Spike-195V | 2019-nCoV Recombinant COVID-19 Spike protein S1 subunit, His-tagged |
S1-His | Baculovirus-Insect Cells |
| Spike-197V | Recombinant COVID-19 Spike protein (S2 ECD), His-tagged | S2(ECD)-His | Baculovirus-Insect Cells |
| N-127V | Recombinant COVID-19 N protein |
N-His | E.coli |
| N-196V | Recombinant COVID-19 Nucleocapsid protein, His-tagged | N-His | Baculovirus-Insect Cells |
| N01-128V | Recombinant COVID-19 N protein truncated N01, His-tagged |
N01-His | E.coli |
| N02-129V | Recombinant COVID-19 N protein truncated N02, His-tagged |
N02-His | E.coli |
| ACE2-736H | Recombinant Human ACE2, His-tagged |
ACE2-His | HEK293 |
| ACE2-68H | Recombinant Human ACE2, Fc-tagged |
ACE2-hFc | HEK293 |
| ACE2-185H | Recombinant Human ACE2, mouse IgG1 Fc-tagged | ACE2-mFc | HEK293 |
参考文献
1. Yan R, Zhang Y, Li Y, et al. Structural basis for the recognition of the SARS-CoV-2 by full-length human ACE2[J]. Science, 2020.
2. Wrapp D, Wang N, Corbett K S, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation[J]. Science, 2020, 367(6483): 1260-1263









