
微信扫一扫
关注公众号
慢病毒稳转株构建原理和实验流程
发布时间:2019-10-12 09:48 | 点击次数:32757
稳定细胞系构建原理
稳定细胞系是指将外源基因整合到宿主细胞基因组中,使外源基因能够在宿主细胞中长期稳定表达,这样的细胞系称为稳定细胞系。其原理是将外源基因克隆到具有某种抗性的载体上,通过转染宿主细胞,外源基因整合到宿主染色体上,用载体中所含抗性基因进行筛选即可得到成功整合目的基因的细胞。在试验过程中,常用的真核表达载体抗性筛选标志物有嘌呤霉素(puromycin)、新霉素(neomycin)、潮霉素(hygromycin)等。通过筛选可得到符合实验要求的稳定高表达目的蛋白细胞株或者稳定沉默目的基因的细胞株。
利用慢病毒感染筛选单克隆是目前最常用的稳定细胞系构建方法之一。慢病毒可以感染几乎所有类型的细胞,并且可以将遗传物质整合到宿主细胞基因组中,进行长时间的稳定表达。
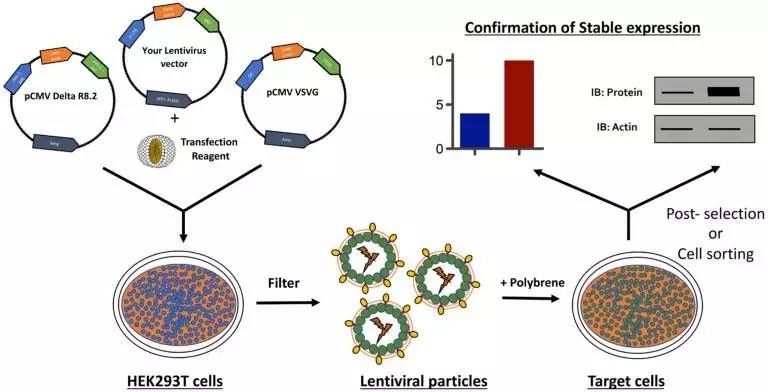
图 1. 使用慢病毒产生稳定细胞系的示意图 (Neha Tandon. 2018)
实验流程及注意事项
1)根据实验目的选择合适的载体
可根据载体抗性、启动子类型、可溶和表达荧光蛋白(GFP/RFP等)、是否需要筛选稳转株等选择合适的载体。
2)构建/选择高效的慢病毒载体
理论上慢病毒系统对外源片段容量能到8 kb,扣除启动子,筛选抗性基因等,应该还能容纳4 kb。但实际上2 kb以上的外源基因包装病毒产量就比2 kb以下的少很多。在做正式实验之前,可先进行小量包装,成功后再进行病毒大量包装。对于knockdown,通常是对一个基因同时选择3个(或以上)干扰靶点,通过qPCR验证干扰效率之后,选择效率最好的靶点进行下一步实验。
1) 取状态良好,处于对数生长期的293T细胞进行慢病毒包装。
2) 细胞铺板:再转染前24 h进行细胞铺板(根据实验需求选择合适的培养皿),转染时细胞密度控制在80%左右。(注意:铺细胞时可左右轻轻摇晃培养皿,以使细胞均有分布在培养皿中。)
3) 转染:取高质量质粒(包括慢病毒包装质粒和慢病毒载体)进行转染。转染完毕放入培养箱中(从生物安全考虑,应将慢病毒包装用的培养箱和普通细胞培养箱分开,培养条件一致)。
由于细胞已开始包装病毒颗粒, 之后的所有操作必需在生物安全柜内小心完成!
4) 换液:转染6~8 h后,将培养皿中的培养液移弃,加入新鲜的适量的培养液。
5) 收集慢病毒颗粒上清:根据实验需要,可收集转染后48 h/72 h的慢病毒颗粒上清。
6) 浓缩:若需要进一步提高慢病毒的滴度,可将收集好的慢病毒颗粒上清进行超速离心(50000 g, 2 h,4℃)。小心移去上清,用少量PBS或培养基溶解慢病毒颗粒(4℃,>2 h)。(注意:超速离心前可先低速离心以去除细胞碎片:3000 g,5 min)。
7) 保存:若直接保存慢病毒颗粒上清,低速离心后便可保存;若保存浓缩后的慢病毒颗粒,高速离心后直接保存即可。4℃可保存一周左右,长时间保存需要放置于-80℃。反复冻融会影响慢病毒的感染效率,建议进行分装保存。
1) 转染前18-24小时进行铺板,转染时细胞密度控制在80%左右。
2) 第二天加入适量病毒悬液。37℃孵育。
3) 继续培养24小时,用新鲜培养基替换含有病毒的培养基。
4) 继续培养。如果慢病毒含有荧光蛋白,一般转染48小时后可见明显荧光表达。在转染3-4天后开始加药筛选。
1) 实验中的关键点
●要确保有效的 ShRNA 慢病毒载体
●慢病毒表达载体的质量
●状态良好无污染的293T细胞系——直接影响慢病毒颗粒的产率
2)生物废弃物的处理
●虽然用于慢病毒包装的质粒均已经过改造, 使其尽可能具有最大的生物安全性。但由于其可以和内源性的病毒重组,形成一个可以自我复制的病毒, 故仍然具有潜在生物公害危险性。因此, 慢病毒包装实验处于NIH生物安全级别2级。
●在实验过程中,仔细穿戴手套以及实验服,操作小心规范,凡是涉及到慢病毒颗粒包装的步骤, 均要在安全2级层流通风橱下进行, 并且操作过程中要尽量降低气溶胶的产生, 一旦有含病毒颗粒的液体溅出,一定要及时清理台面。
●所有相关的培养基及废弃物在弃置前需要高压灭菌方法灭活。在带离实验区前, 需要在有标记的(生物公害, 有传染性垃圾)容器内密封后方可带出。
参考文献
-
Neha Tandon,. et al. Generation of Stable Expression Mammalian Cell Lines Using Lentivirus. Bio Protoc. 2018; 8(21): e3073.
-
Kailin Xu. et al. Generation of a Stable Cell Line Producing High-Titer Self-Inactivating Lentiviral Vectors. Molecular Therapy. 2001. 3(1):97-104









