
微信扫一扫
关注公众号
蛋白纯化指导要点及技术概览
发布时间:2019-08-13 12:13 | 点击次数:1082
转载自公众号:北京安必奇生物科技有限公司
无论是蛋白研究还是应用,通常需要将蛋白利用不同的生物系统(如大肠杆菌,酵母,昆虫杆状病毒,哺乳动物细胞蛋白表达系统等)表达出来,然后进行分离和纯化。研究实验室通常需要纯化微克或毫克级别的蛋白质,而GMP蛋白生产需要纯化数千克甚至数吨的蛋白质。因此,蛋白纯化非常重要。纯化过程中,主要需要考虑宿主污染、样品的可溶性、蛋白结构的完整性和生物活性。蛋白的纯化可大致分为样品捕获、中度纯化阶段和精细纯化阶段3个阶段。
样品捕获:分离、浓缩和稳定化处理;
中度纯化:去除核酸等其他细胞成分,可使用硫酸铵沉淀法;
精细纯化:将靶蛋白与其他大小及理化性质接近的蛋白区分开来,常用方法包括凝胶过滤层析、离子交换层析、亲和层析等。
蛋白纯化指导原则
1. 明确目标,避免过度纯化或者纯化不够;
表1. 对蛋白样本纯度要求的例子。
| 纯度要求 |
蛋白应用 |
| 非常高,> 99% |
生物治疗;体内试验 |
| 高,> 95%-99% |
X射线衍射晶体分析,多数物理、化学特性鉴定方法 |
| 适中,< 95% |
用抗原来制备抗体、N端测序分析 |
2、明确样本特性和主要的杂质,选择合适的纯化方法;
可以通过检测蛋白稳定性窗口(如pH值、离子强度)和蛋白基础数据(如蛋白大小、等电点pl、疏水性、可溶性等)快速确定纯化技术组合。
3、能够快速检测蛋白的回收率、活性和杂质情况;
4、尽量减少步骤,从而避免样本损失过多和活性降低过多;
5、尽早除去蛋白酶等对样品有损害的杂质;
6、尽量少使用添加剂,否则可能需要额外的步骤去除添加剂。
由于样品和蛋白的性质各异,所含杂质也不尽相同,因此需要采用不同的蛋白纯化策略。目前主要有六种蛋白纯化方法:凝胶过滤层析、离子交换层析、标签纯化、亲和层析、疏水作用层析、电泳等。其他方法也可用于蛋白纯化,比如利用蛋白的热稳定性、蛋白酶解稳定性、溶解度等特性纯化蛋白。
凝胶过滤层析是一种高效的蛋白分离纯化方法,根据分子大小的差异分离蛋白质混合物。在蛋白溶液通过含有填充颗粒的凝胶过滤层析柱时,由于不同蛋白的分子大小不同,扩散进入特定大小孔径颗粒的能力也因此各不相同,大分子蛋白率先被洗脱出来,分子量越小,洗脱越晚,从而达到蛋白分离和纯化的目的。一般来说,越细、越长的凝胶过滤层析柱的纯化效果越好。
该技术具有诸多优点:温和,样本不易变性,几乎不会和蛋白质发生任何作用,重复性好,不使用有机溶剂,回收率高等。该方法可用于蛋白纯化、分子量及其分布范围测定,更换缓冲液、脱盐等。
离子交换层析是基于蛋白表面所带电荷种类、数量和分布的不同进行蛋白分离纯化的技术,在特定条件下,点电荷的蛋白可与阳/阴离子交换柱结合,并呈现出结合强度上的差异。该结合是可逆的,在离子交换色谱时按结合力由弱到强的顺序被逐渐洗脱下来,实现蛋白的分离纯化。该技术具有分辨率高、蛋白交换容量高、应用灵活、分离原理明确、操作简单易行等优点,适合实验室和工业规模应用,而凝胶过滤很难实现工业规模应
图1. 离子交换层析。
亲和层析是利用生物大分子与配基的专一性可逆吸附进行蛋白分离纯化。该方法具有特异性高、条件温和、速度快、效率高等有优点,适合从复杂样本、杂质含量高的样本中提纯靶蛋白。可利用目标蛋白与配基的特异性吸附,也可通过加入标签,再利用标签与配基的特异性结合,实现蛋白分离纯化(即下面的标签纯化)。
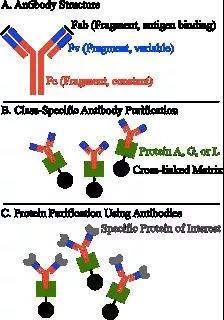
图2. 利用蛋白A、G、L进行亲和层析的原理示意图。
标签纯化利用基因重组技术在蛋白的氨基端或者羧基端加入几个额外氨基酸,作为标签,利于分离纯化。常见的标签包括GST、His、MBP、Strep-tag™ II等。
GST标签:在蛋白质序列中加入谷胱甘肽S转移酶(GST),再利用Glutathione Sepharose 4B 作亲和纯化,用凝血酶或因子Xa切开。该方法条件温和,能保留靶蛋白的抗原性和功能。
His标签:组氨酸(His)是最常见的标签之一,因为组氨酸很小,几乎不影响靶蛋白的功能、活性和结构。在氨基酸加上6-10个组氨酸,在变性条件下,由于他能与Ni2+螯合柱紧密结合,再用咪唑洗脱,实现蛋白分离纯化。
疏水作用层析的原理是:在高离子强度下,盐-水体系中的蛋白质部分去溶剂化,内部疏水基团暴露出来,这些残基可与介质中的疏水官能团发生可逆的疏水相互作用。当降低离子浓度时,蛋白的疏水基团隐藏起来,作用消失,完成洗脱。由于不同蛋白与介质中疏水性配基间的疏水作用力不同,实现蛋白的分离纯化。该方法成本低,能保留蛋白的生物活性,使用广泛。
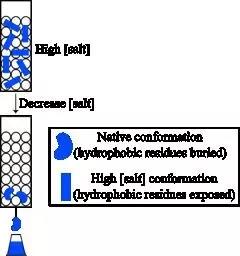
图3. 疏水作用层析。
电泳
电泳分离纯化蛋白的原理是,在电场作用下,带点胶体颗粒朝电性相反的电极运动,并且分子越大,运动速度越慢。SDS-PAGE可用于蛋白质的分离纯化,通过染色剂,可对蛋白进行显色。优点是易操作、经济、直观;缺点是不能大规模运用。
图4. SDS-PAGE。
通常使用十二烷基硫酸钠聚丙烯酰氨凝胶(SDS-PAGE)、毛细管电泳、反相色谱法和质谱法对靶蛋白的纯度进行评价。Lowry(Folin-酚试剂法)或者Bradford(考马斯亮蓝法)分析方法经常用于总蛋白质含量的测定。Bradford法的灵敏度更高,非常适合分析脂类含量高的样品,脂类杂质可能会干扰Lowry法的灵敏性。
参考资料:Caroline Ritchie. An in-depth review of column chromatography for protein purification and survey result from 305 formal publications. 2012, http://doi.org/10.13070/mm.cn.2.134
转载自:北京安必奇生物科技有限公司









